- HÉMOGLOBINE
- HÉMOGLOBINEL’hémoglobine est la molécule d’importance vitale qui, chez les Vertébrés, achemine l’oxygène depuis les poumons, ou les branchies, jusqu’aux tissus, et en retour favorise le transport, par le sang, du gaz carbonique des tissus aux poumons, ou aux branchies.Étant une protéine, l’hémoglobine se compose d’aminoacides liés entre eux de façon séquentielle en une chaîne linéaire dite polypeptidique. Les diverses sortes d’aminoacides qui réalisent cette chaîne se succèdent en fonction d’un déterminisme génétique qui assigne à chacun sa place dans la séquence polypeptidique.La molécule d’hémoglobine est formée par quatre chaînes polypeptidiques deux à deux semblables: deux chaînes 見 qui contiennent 141 maillons aminoacides et deux chaînes 廓 qui en renferment 146. Bien que leurs séquences en aminoacides soient différentes, ces chaînes 見 et 廓 sont repliées en structures tridimensionnelles à conformation similaire. Chaque chaîne abrite un hème , petite molécule cyclique porphyrinique (donnant sa couleur rouge au sang). Elle est constituée par un anneau d’atomes de carbone, d’azote et d’hydrogène, au centre duquel s’attache un atome de fer. Un polypeptide, avec l’hème qu’il porte, forme une sous-unité qu’on appelle monomère de la molécule d’hémoglobine. Celle-ci rassemble donc quatre sous-unités en tétramère selon un puzzle tridimensionnel en zigzag.1. Rôle de l’hémoglobineLe muscle rouge contient une protéine, la myoglobine, qui ressemble par sa constitution et sa structure à la sous-unité 廓 de l’hémoglobine, car elle est formée d’une seule chaîne polypeptidique à laquelle s’attache un hème.La myoglobine se combine à l’oxygène que lui cèdent les globules rouges du sang; après s’en être chargée, elle l’apporte aux mitochondries, organites subcellulaires dans lesquels de l’énergie est libérée, à la faveur des processus de combustion du glucose, avec formation de dioxyde de carbone et d’eau.Avec ses 2 500 atomes de carbone, azote, oxygène, hydrogène et soufre, la myoglobine, plus simple que l’hémoglobine, possède une structure tridimensionnelle qui fut la première à être élucidée, par J. C. Kendrew et ses collaborateurs. Elle a pour seule fonction de permettre la liaison chimique labile entre son unique atome de fer et une molécule d’oxygène: O2. Lorsqu’elle est dépourvue d’oxygène, une solution de myoglobine ou d’hémoglobine est pourpre, comme le sang veineux, lorsque l’oxygène lui est insufflé, elle devient écarlate, comme le sang artériel. Si, dans leur fonction de transporteur d’oxygène, ces deux protéines doivent coopérer, l’une, l’hémoglobine, prélèvera de l’oxygène dans les poumons, où il est abondant, pour le donner à l’autre, la myoglobine, dans les capillaires du muscle où ce gaz est en faible quantité; la myoglobine, à son tour passera l’oxygène aux mitochondries, où il est plus raréfié encore.Une expérience simple montre que myoglobine et hémoglobine peuvent accomplir cet échange parce qu’il y a un équilibre entre l’oxygène libre et l’oxygène lié au fer de l’hème. Imaginons un récipient construit de manière à pouvoir mélanger un grand volume de gaz à une solution de myoglobine, et permettant d’étudier les variations de sa couleur à l’aide d’un spectroscope. En l’absence d’oxygène, on observe seulement la coloration pourpre de la désoxymyoglobine. Si on introduit un peu d’oxygène, une certaine quantité de celui-ci se combine à une quantité aliquote de désoxymyoglobine pour produire de l’oxymyoglobine de couleur écarlate. On évalue à l’aide du spectroscope la quantité d’oxymyoglobine dans la solution. On répète l’expérience (introduction d’oxygène, puis mesure spectroscopique) jusqu’à ce que la totalité de la myoglobine ait viré à l’écarlate. Les résultats obtenus permettent de construire un graphe orthonormé en portant sur un axe horizontal la pression partielle d’oxygène et sur un axe vertical le pourcentage d’oxymyoglobine correspondant. La courbe est une hyperbole rectangulaire: elle grimpe fortement dès le début, lorsque les molécules de myoglobine sont toutes libres, et elle s’aplatit à la fin, quand les molécules de myoglobine libres se sont à ce point raréfiées que seule une pression partielle élevée d’oxygène peut les saturer (fig. 1). La myoglobine absorbe l’oxygène facilement et se sature ainsi à basse pression partielle de ce gaz. Au contraire, pour l’hémoglobine la courbe est sigmoïde, car l’affinité pour l’oxygène, faible à basse pression partielle de ce gaz, augmente à mesure qu’il est fixé.L’équilibre est traduit de manière plus satisfaisante par un graphe dans lequel le rapport existant entre les molécules d’oxymyoglobine (x ) et de désoxymyoglobine (1-x ) est référé au logarithme de la pression partielle d’oxygène. La courbe devient une ligne droite inclinée à 45 degrés par rapport aux axes des coordonnées. L’intersection de cette ligne avec une horizontale tracée à x /(1-x ) = 1 donne la constante d’équilibre K. C’est la pression partielle d’oxygène exacte pour laquelle 50 p. 100 des molécules de myoglobine sont chargées d’oxygène. Plus l’affinité de la protéine pour l’oxygène est grande, plus est basse la pression nécessaire pour obtenir la demi-saturation, et plus est faible la constante d’équilibre. La pente à 450 demeure inchangée, mais des affinités faibles pour l’oxygène sont caractérisées par des courbes déplacées vers la droite et les plus fortes affinités par des courbes déplacées vers la gauche.Si la même expérience est réalisée avec du sang ou avec une solution d’hémoglobine, on obtient un résultat entièrement différent (fig. 2): la courbe s’élève au début doucement puis elle grimpe très vite et finalement s’aplatit en rejoignant la courbe de la myoglobine. On retrouve donc, encore plus nette, cette étrange forme sigmoïde qui signifie que, lorsqu’elles ne sont pas porteuses d’oxygène, c’est-à-dire à l’état de désoxyhémoglobine, les molécules de ce pigment répugnent à fixer les premières molécules d’oxygène disponible, mais que leur «appétit» d’oxygène croît à mesure qu’elles absorbent ce gaz. Inversement, la perte d’oxygène par certains hèmes affaiblit l’affinité des autres vis-à-vis de lui. La localisation de l’oxygène dans les molécules d’hémoglobine d’une solution évoque donc la parabole biblique du riche et du pauvre: «À tout possédant il sera donné, et il possédera en abondance; mais à celui qui est dépourvu, il sera retiré le peu qu’il a». Ce phénomène signifie qu’il y a une sorte de relation entre les hèmes d’une même molécule, et les physiologistes l’ont appelée «interaction hème-hème».La meilleure image du mécanisme sous-jacent à l’interaction hème-hème est donnée par le graphe logarithmique (fig. 2). La courbe d’équilibre commence en ligne droite, inclinée à 450 par rapport aux axes du graphique, parce que, au début, les molécules d’oxygène sont si rares qu’un seul hème dans chaque molécule d’hémoglobine a une chance de se saisir de l’une d’elles, et tous les hèmes, de ce fait, réagissent de façon indépendante, comme dans le cas de la myoblogine. À mesure que l’oxygène est introduit en quantité croissante, les quatre hèmes de chaque molécule entrent en interaction, la courbe s’infléchit. La tangente à la pente maximale de la courbe est le coefficient de Hill, n , ainsi nommé en l’honneur du physiologiste A. V. Hill, qui, le premier, a tenté d’expliquer mathématiquement la réaction d’équilibre avec l’oxygène. La valeur normale de ce coefficient de Hill est environ 3; en l’absence d’interaction hème-hème, il tombe à l’unité.La courbe s’achève avec une pente de 450 vis-à-vis des deux axes parce que l’oxygène est maintenant si abondant que seul le dernier hème de chaque molécule a des chances d’être libre, et tous les hèmes de cette solution réagissent à nouveau indépendamment les uns des autres.2. Effets coopératifs dans la fixation d’oxygèneOn désigne sous ce nom l’interaction hème-hème et aussi d’autres mécanismes modifiant réversiblement l’affinité de l’hémoglobine pour l’oxygène. Cette affinité, et le coefficient de Hill qui l’exprime, dépendent de la concentration de divers facteurs dans le globule rouge: protons (atomes d’hydrogène dépourvus d’électrons dont la concentration peut être évaluée par le pH), dioxyde de carbone (CO2), ions chlore (Cl-) et un composé entre acide glycérique et phosphate que l’on appelle le 2.3. diphosphoglycérate (DPG).Accroître la concentration de chacun d’eux déplace la courbe d’équilibre de l’oxygénation vers la droite, dans le sens de l’affinité plus faible pour l’oxygène, et accentue la forme sigmoïde de la courbe. Curieusement, aucun de ces facteurs n’influence (comme le fait la température) la courbe d’équilibre de l’oxygénation de la myoglobine, bien que, pourtant, sa molécule soit chimiquement et structurellement très comparable à une sous-unité de l’hémoglobine.Quelle est la signification de ces effets extraordinaires? Pourquoi ne suffit-il pas au globule rouge d’être un simple transporteur d’oxygène comme la myoglobine? Parce qu’un tel transporteur ne permettrait pas le départ d’une assez grande quantité d’oxygène du globule rouge vers les tissus, et il ne permettrait pas au plasma sanguin de contenir assez de gaz carbonique destiné à l’excrétion pulmonaire. La pression partielle d’oxygène dans les poumons est d’environ 100 mm de mercure, ce qui suffit pour saturer d’oxygène l’hémoglobine, que la courbe d’équilibre soit sigmoïde ou hyperbolique. Dans le sang veineux, la pression partielle n’est plus que de 35 mm et, si la courbe était hyperbolique (comme celle de la myoglobine) il ne serait libéré, sous une telle pression, qu’à peine 10 p. 100 de l’oxygène transporté, ce qui entraînerait l’asphyxie du sujet respirant pourtant normalement, mais il en sera libéré en fait cinq fois plus!Plus la forme de la courbe d’équilibre est sigmoïde, plus la fraction d’oxygène libérée est importante. Divers facteurs y contribuent. L’oxydation des nutriments par les tissus libère des acides, lactique et carbonique; ces acides fournissent des protons qui déplacent la courbe vers la droite, vers la moindre affinité de l’oxygène pour l’hémoglobine, accentuant sa forme sigmoïde. Le DPG joue aussi un rôle important. Le nombre des molécules de DPG dans le globule rouge est à peu près égal à celui des molécules d’hémoglobine, 280 millions, et il reste à peu près constant, probablement, pendant la circulation; une insuffisance d’oxygène dans le sang entraîne une fabrication accrue de DPG, laquelle contribue à libérer davantage d’oxygène. Ainsi, dans le cas de la courbe sigmoïde typique (fig. 1), près de 50 p. 100 de l’oxygène transporté est cédé aux tissus. En revanche, chez le fœtus humain, l’hémoglobine renferme bien les mêmes chaînes 見 que celles de l’adulte mais les chaînes 廓 sont différentes, déterminant une moins grande affinité pour le DPG. Il s’ensuit que l’hémoglobine fœtale possède une plus grande affinité pour l’oxygène, ce qui facilite le transfert de ce gaz du sang maternel au sang du fœtus.Le monoxyde de carbone (CO) peut se lier avec le fer de l’hème, au même site que l’oxygène, mais avec une affinité 250 fois plus grande; il en chasse donc l’oxygène, ce qui explique sa grande toxicité. Chez les grands fumeurs, plus de 15 p. 100 des sites de combinaison de l’oxygène peuvent être ainsi bloqués par CO, d’où la diminution de la quantité d’oxygène transportée par le sang. Mais le monoxyde de carbone a un effet plus pernicieux encore. La combinaison de l’un des quatre hèmes d’une molécule d’hémoglobine avec le monoxyde de carbone augmente, par interaction hème-hème, l’affinité pour l’oxygène, des trois hèmes restant disponibles. La courbe d’équilibre de l’oxygène est alors déplacée vers la gauche et ainsi se trouve diminuée la fraction de l’oxygène transporté susceptible d’être libérée dans les tissus.Si les protons abaissent l’affinité de l’hémoglobine pour l’oxygène, alors la loi d’action et réaction veut que l’oxygène diminue l’affinité de l’hémoglobine pour les protons. En perdant de l’oxygène, l’hémoglobine va donc se combiner aux protons et vice versa. Deux protons environ sont captés pour quatre molécules d’oxygène abandonnées, et deux protons sont libérés lorsque quatre molécules d’oxygène sont fixées. Cette réciprocité s’appelle l’effet Bohr et c’est la clé du mécanisme du transport du gaz carbonique. Tout le C2 fourni par la respiration des tissus ne peut être transporté faute de solubilité, mais il est solubilisé en s’unissant à l’eau pour former un ion bicarbonate et un proton selon l’équation
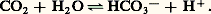 En l’absence d’hémoglobine, cette réaction devrait s’arrêter rapidement par suite de la quantité élevée des protons libérés, comme un feu s’éteint si une cheminée se bouche. La désoxyhémoglobine neutralise les protons, en jouant le rôle d’une base, favorisant ainsi la formation de bicarbonate soluble. Le processus s’inverse dans les poumons. Là, du fait de la fixation d’oxygène sur l’hémoglobine, les protons sont expulsés, ce qui chasse le dioxyde de carbone de sa solution, et permet de l’excréter.3. Structure et fonction de la moléculeFélix Haurowitz a découvert en 1938 que la désoxyhémoglobine et l’oxyhémoglobine cristallisaient différemment, comme si elles étaient chimiquement différentes, ce qui implique que l’hémoglobine n’est pas un bidon d’oxygène mais un poumon moléculaire dont la structure change selon qu’il capte l’oxygène ou qu’il s’en décharge.En 1965, Jacques Monod et J.-P. Changeux, ainsi que Jeffries Wyman ont expliqué cette particularité par la notion d’allostérie . Selon celle-ci, les deux structures se distinguent par l’arrangement des sous-unités et par le nombre et la force de leurs liaisons mutuelles. L’une peut développer pleinement son affinité avec l’oxygène à cause de la faiblesse et de la rareté de ces liaisons. C’est la structure R, ou «relaxée». L’autre, à basse affinité, du fait des liaisons plus nombreuses et plus fortes entre les sous-unités, est dite structure T, ce qui signifie «tensive». Dans chacune de ces structures l’affinité pour l’oxygène des diverses sous-unités d’une même molécule devrait rester invariable.Ce postulat a conduit à décrire les propriétés des molécules allostériques en utilisant un modèle mathématique à trois variables indépendantes: KR et KT, qui caractérisent comme on l’a vu plus haut les constantes d’équilibre de la liaison de l’oxygène avec l’hémoglobine (selon la structure R ou T de celle-ci) et L qui exprime le rapport, mesuré en l’absence d’oxygène, du nombre des molécules à structure T au nombre des molécules R (fig. 3).Cette ingénieuse théorie simplifie grandement l’interprétation de l’effet coopératif. L’affinité croissante pour l’oxygène, que nous avons imaginée par la parabole du riche et du pauvre, ne provient pas de quelque interaction directe entre les hèmes mais de la translation d’une structure T à basse affinité à une structure R à haute affinité. Cette modification pourrait se produire soit quand la seconde molécule d’oxygène se lie, soit quand la troisième vient se fixer. Des agents chimiques qui ne se fixent pas aux hèmes peuvent donc abaisser l’affinité pour l’oxygène en biaisant l’équilibre entre les deux structures en faveur de la forme T, tout en ménageant la transition ultérieure à la forme R, d’où trois molécules d’oxygène liées, alors que deux seulement l’avaient été initialement. En termes d’allostérie, de tels agents élèveraient L, nombre relatif des molécules à structure T, sans altérer les constantes d’équilibre KT et KR des deux structures. En fait, tous ces agents augmentent KT en même temps.La structure globale des sous-unités est semblable dans la myoglobine et dans les chaînes 見 et 廓 de l’hémoglobine (fig. 4). Les chaînes 見 renferment 7 segments hélicoïdaux et les chaînes 廓 en contiennent 8, raccordés par des coudes et des segments non hélicoïdaux. Chaque chaîne enveloppe son hème dans une profonde poche qui expose seulement le côté d’où les chaînes d’acide propionique de la porphyrine peut plonger dans l’eau environnante. L’hème est en contact avec des chaînons latéraux de 16 aminoacides à partir des 7 segments de chaîne 見 ou 廓.La plupart de ces chaînons sont hydrocarbonés, avec deux exceptions, celles des histidines liées à l’hème, de part et d’autre de celui-ci, jouant un rôle important dans la liaison avec l’oxygène. La partie terminale du chaînon de l’histidine en cause est un cycle imidazole à 3 atomes de carbone, deux atomes d’azote et 4 ou 5 d’hydrogène. L’une des histidines, dite proximale, est liée à l’atome de fer de l’hème (fig. 5). L’autre histidine, dite distale, s’attache du côté opposé de l’hème par une liaison hydrogène avec l’oxygène fixé. À part ces chaînons histidine, la plupart des autres chaînons étant hydrocarbonés, l’extérieur de la molécule d’hémoglobine est bordé de chaînons divers, parmi lesquels prédominent les chaînons électriquement chargés et les dipolaires. Ainsi chaque sous-unité est hydrophobe en dedans et hydrophile en dehors, donc soluble dans l’eau mais imperméable à elle.Les quatre sous-unités sont disposées au sommet d’un tétraèdre, dans lequel existe une double symétrie. Un tétraèdre ayant six côtés, il y a six zones de contact entre les sous-unités (fig. 6). Les nombreuses liaisons hydrogène entre les sous-unités 見1- 廓1 et 見2- 廓2 les font adhérer si fortement selon les zones de contact, que la réaction avec l’oxygène modifie à peine cette situation et les paires de sous-unités se déplacent à la manière de corps rigides lors de la transition T-R.Pourtant le contact 見1- 廓2 dans la structure R semble très différent de ce qu’il est dans la structure T. Ce contact inclut moins de chaînons latéraux que le contact 見1- 廓1 et il est conformé de manière à agir comme un déclencheur, avec deux positions alternativement stables, chacune fixée par un agencement différent des liaisons hydrogènes (fig. 7). Entre les sous-unités de la structure T, les liaisons accessoires prévues par la théorie allostérique seraient situées au bout des chaînons polypeptidiques. Le dernier résidu aminoacide de chacun d’eux forme des ponts de coordinence avec les sous-unités voisines (un pont de coordinence ou liaison semi-polaire est une liaison entre un atome d’azote chargé positivement et un atome d’oxygène porteur d’une charge négative).Géométriquement, la transition entre les deux structures (fig. 7) a lieu par mouvement de bascule du dimère 見1- 廓1 par rapport au dimère 見2- 廓2. Si l’un était maintenu fixe, le mouvement de l’autre se traduirait par une rotation de près de 150 au niveau d’un axe de situation adéquate, associée à un léger glissement le long dudit axe. Le mouvement est obtenu par un changement minime de la structure interne des sous-unités lors de la fixation ou de la libération d’oxygène.Les ponts de coordinance terminaux des chaînons polypeptides fournissent évidemment les liaisons accessoires entre sous-unités dans la structure prévue par Monod, Changeux et Wyman. Ils expliquent aussi l’allure de la courbe d’équilibre avec l’oxygène en présence de facteurs chimiques variés. Tous ceux qui abaissent l’affinité pour l’oxygène le font soit en renforçant les ponts de coordinence existant déjà dans la structure T, soit en en créant de nouveaux. Cependant, certaines de ces liaisons supplémentaires ne sont pas installées entre les sous-unités: elles s’établissent en dedans de celles-ci et résistent aux changements structuraux subtils que les sous-unités subissent en se liant à l’oxygène.Les liaisons polaires expliquent à la fois l’abaissement de l’affinité pour l’oxygène en présence de protons et la fixation de protons lors de la libération de l’oxygène. Les protons augmentent en effet le nombre d’atomes d’azote porteurs d’une charge positive. Par exemple, le cycle imidazole de l’histidine peut exister sous deux formes, l’une déchargée quand l’un seulement de ses atomes d’azote porte un proton, l’autre chargée quand les deux en portent. En solution neutre, chaque histidine a une chance sur deux d’être chargée positivement. L’acidification, autrement dit l’augmentation de la concentration en protons, augmente l’éventualité de charge positive de l’histidine (et par suite la formation d’un pont de coordinence avec un atome d’oxygène porteur de charge négative).Au contraire, la transition de la structure R à la structure T rapproche des atomes d’oxygène négativement chargés et des atomes d’azote non chargés, ce qui économise le travail nécessité par la charge d’un atome d’azote. Ainsi, une histidine, qui n’a pas une chance sur deux d’être positivement chargée dans la structure R, a 90 p. 100 de chances de l’être dans la structure T, si bien que davantage de protons sont fixés dans une solution en présence d’hémoglobine de structure T.La plus frappante différence entre les structures T et R réside dans la largeur de l’intervalle entre les deux chaînes 廓. Dans la structure T, les deux chaînes sont largement séparées et l’interstice qui les sépare est bordé d’aminoacides à chaînons latéraux chargés positivement. Cet interstice est taillé pour s’adapter à la molécule de 2.3 diphosphoglycérate et y compenser ses charges négatives, de telle sorte que la liaison avec le DPG accroît le nombre des ponts de coordinence en structure T.En structure R, l’intervalle se rétrécit et le DPG doit se détacher. De la sorte, le DPG renforce la structure T et abaisse l’affinité pour l’oxygène.
En l’absence d’hémoglobine, cette réaction devrait s’arrêter rapidement par suite de la quantité élevée des protons libérés, comme un feu s’éteint si une cheminée se bouche. La désoxyhémoglobine neutralise les protons, en jouant le rôle d’une base, favorisant ainsi la formation de bicarbonate soluble. Le processus s’inverse dans les poumons. Là, du fait de la fixation d’oxygène sur l’hémoglobine, les protons sont expulsés, ce qui chasse le dioxyde de carbone de sa solution, et permet de l’excréter.3. Structure et fonction de la moléculeFélix Haurowitz a découvert en 1938 que la désoxyhémoglobine et l’oxyhémoglobine cristallisaient différemment, comme si elles étaient chimiquement différentes, ce qui implique que l’hémoglobine n’est pas un bidon d’oxygène mais un poumon moléculaire dont la structure change selon qu’il capte l’oxygène ou qu’il s’en décharge.En 1965, Jacques Monod et J.-P. Changeux, ainsi que Jeffries Wyman ont expliqué cette particularité par la notion d’allostérie . Selon celle-ci, les deux structures se distinguent par l’arrangement des sous-unités et par le nombre et la force de leurs liaisons mutuelles. L’une peut développer pleinement son affinité avec l’oxygène à cause de la faiblesse et de la rareté de ces liaisons. C’est la structure R, ou «relaxée». L’autre, à basse affinité, du fait des liaisons plus nombreuses et plus fortes entre les sous-unités, est dite structure T, ce qui signifie «tensive». Dans chacune de ces structures l’affinité pour l’oxygène des diverses sous-unités d’une même molécule devrait rester invariable.Ce postulat a conduit à décrire les propriétés des molécules allostériques en utilisant un modèle mathématique à trois variables indépendantes: KR et KT, qui caractérisent comme on l’a vu plus haut les constantes d’équilibre de la liaison de l’oxygène avec l’hémoglobine (selon la structure R ou T de celle-ci) et L qui exprime le rapport, mesuré en l’absence d’oxygène, du nombre des molécules à structure T au nombre des molécules R (fig. 3).Cette ingénieuse théorie simplifie grandement l’interprétation de l’effet coopératif. L’affinité croissante pour l’oxygène, que nous avons imaginée par la parabole du riche et du pauvre, ne provient pas de quelque interaction directe entre les hèmes mais de la translation d’une structure T à basse affinité à une structure R à haute affinité. Cette modification pourrait se produire soit quand la seconde molécule d’oxygène se lie, soit quand la troisième vient se fixer. Des agents chimiques qui ne se fixent pas aux hèmes peuvent donc abaisser l’affinité pour l’oxygène en biaisant l’équilibre entre les deux structures en faveur de la forme T, tout en ménageant la transition ultérieure à la forme R, d’où trois molécules d’oxygène liées, alors que deux seulement l’avaient été initialement. En termes d’allostérie, de tels agents élèveraient L, nombre relatif des molécules à structure T, sans altérer les constantes d’équilibre KT et KR des deux structures. En fait, tous ces agents augmentent KT en même temps.La structure globale des sous-unités est semblable dans la myoglobine et dans les chaînes 見 et 廓 de l’hémoglobine (fig. 4). Les chaînes 見 renferment 7 segments hélicoïdaux et les chaînes 廓 en contiennent 8, raccordés par des coudes et des segments non hélicoïdaux. Chaque chaîne enveloppe son hème dans une profonde poche qui expose seulement le côté d’où les chaînes d’acide propionique de la porphyrine peut plonger dans l’eau environnante. L’hème est en contact avec des chaînons latéraux de 16 aminoacides à partir des 7 segments de chaîne 見 ou 廓.La plupart de ces chaînons sont hydrocarbonés, avec deux exceptions, celles des histidines liées à l’hème, de part et d’autre de celui-ci, jouant un rôle important dans la liaison avec l’oxygène. La partie terminale du chaînon de l’histidine en cause est un cycle imidazole à 3 atomes de carbone, deux atomes d’azote et 4 ou 5 d’hydrogène. L’une des histidines, dite proximale, est liée à l’atome de fer de l’hème (fig. 5). L’autre histidine, dite distale, s’attache du côté opposé de l’hème par une liaison hydrogène avec l’oxygène fixé. À part ces chaînons histidine, la plupart des autres chaînons étant hydrocarbonés, l’extérieur de la molécule d’hémoglobine est bordé de chaînons divers, parmi lesquels prédominent les chaînons électriquement chargés et les dipolaires. Ainsi chaque sous-unité est hydrophobe en dedans et hydrophile en dehors, donc soluble dans l’eau mais imperméable à elle.Les quatre sous-unités sont disposées au sommet d’un tétraèdre, dans lequel existe une double symétrie. Un tétraèdre ayant six côtés, il y a six zones de contact entre les sous-unités (fig. 6). Les nombreuses liaisons hydrogène entre les sous-unités 見1- 廓1 et 見2- 廓2 les font adhérer si fortement selon les zones de contact, que la réaction avec l’oxygène modifie à peine cette situation et les paires de sous-unités se déplacent à la manière de corps rigides lors de la transition T-R.Pourtant le contact 見1- 廓2 dans la structure R semble très différent de ce qu’il est dans la structure T. Ce contact inclut moins de chaînons latéraux que le contact 見1- 廓1 et il est conformé de manière à agir comme un déclencheur, avec deux positions alternativement stables, chacune fixée par un agencement différent des liaisons hydrogènes (fig. 7). Entre les sous-unités de la structure T, les liaisons accessoires prévues par la théorie allostérique seraient situées au bout des chaînons polypeptidiques. Le dernier résidu aminoacide de chacun d’eux forme des ponts de coordinence avec les sous-unités voisines (un pont de coordinence ou liaison semi-polaire est une liaison entre un atome d’azote chargé positivement et un atome d’oxygène porteur d’une charge négative).Géométriquement, la transition entre les deux structures (fig. 7) a lieu par mouvement de bascule du dimère 見1- 廓1 par rapport au dimère 見2- 廓2. Si l’un était maintenu fixe, le mouvement de l’autre se traduirait par une rotation de près de 150 au niveau d’un axe de situation adéquate, associée à un léger glissement le long dudit axe. Le mouvement est obtenu par un changement minime de la structure interne des sous-unités lors de la fixation ou de la libération d’oxygène.Les ponts de coordinance terminaux des chaînons polypeptides fournissent évidemment les liaisons accessoires entre sous-unités dans la structure prévue par Monod, Changeux et Wyman. Ils expliquent aussi l’allure de la courbe d’équilibre avec l’oxygène en présence de facteurs chimiques variés. Tous ceux qui abaissent l’affinité pour l’oxygène le font soit en renforçant les ponts de coordinence existant déjà dans la structure T, soit en en créant de nouveaux. Cependant, certaines de ces liaisons supplémentaires ne sont pas installées entre les sous-unités: elles s’établissent en dedans de celles-ci et résistent aux changements structuraux subtils que les sous-unités subissent en se liant à l’oxygène.Les liaisons polaires expliquent à la fois l’abaissement de l’affinité pour l’oxygène en présence de protons et la fixation de protons lors de la libération de l’oxygène. Les protons augmentent en effet le nombre d’atomes d’azote porteurs d’une charge positive. Par exemple, le cycle imidazole de l’histidine peut exister sous deux formes, l’une déchargée quand l’un seulement de ses atomes d’azote porte un proton, l’autre chargée quand les deux en portent. En solution neutre, chaque histidine a une chance sur deux d’être chargée positivement. L’acidification, autrement dit l’augmentation de la concentration en protons, augmente l’éventualité de charge positive de l’histidine (et par suite la formation d’un pont de coordinence avec un atome d’oxygène porteur de charge négative).Au contraire, la transition de la structure R à la structure T rapproche des atomes d’oxygène négativement chargés et des atomes d’azote non chargés, ce qui économise le travail nécessité par la charge d’un atome d’azote. Ainsi, une histidine, qui n’a pas une chance sur deux d’être positivement chargée dans la structure R, a 90 p. 100 de chances de l’être dans la structure T, si bien que davantage de protons sont fixés dans une solution en présence d’hémoglobine de structure T.La plus frappante différence entre les structures T et R réside dans la largeur de l’intervalle entre les deux chaînes 廓. Dans la structure T, les deux chaînes sont largement séparées et l’interstice qui les sépare est bordé d’aminoacides à chaînons latéraux chargés positivement. Cet interstice est taillé pour s’adapter à la molécule de 2.3 diphosphoglycérate et y compenser ses charges négatives, de telle sorte que la liaison avec le DPG accroît le nombre des ponts de coordinence en structure T.En structure R, l’intervalle se rétrécit et le DPG doit se détacher. De la sorte, le DPG renforce la structure T et abaisse l’affinité pour l’oxygène.
hémoglobine [ emɔglɔbin ] n. f.• 1869; de hémo- et du rad. de globuline♦ Pigment respiratoire des mammifères, protéine contenue dans les hématies qui assure le transport de l'oxygène. ⇒ hème, oxyhémoglobine. Hémoglobine fœtale, synthétisée par le fœtus et disparaissant après la naissance.♢ Cour. et fam. Sang. Film d'horreur avec des flots d'hémoglobine. Le « bon vieux Grand-Guignol d'autrefois où ruisselait l'hémoglobine » (San-Antonio).
● hémoglobine nom féminin Pigment protéique des globules rouges du sang, assurant le transport de l'oxygène entre l'appareil respiratoire et les cellules de l'organisme. Familier. Sang. ● hémoglobine (expressions) nom féminin Hémoglobine glycosylée, hémoglobine sur laquelle s'est fixée une molécule de glucose.hémoglobinen. f. BIOCHIM Pigment rouge des hématies des vertébrés qui, par une liaison réversible, transporte l'oxygène des alvéoles pulmonaires vers les tissus.Encycl. L'hémoglobine est une hétéroprotéine synthétisée par les érythroblastes, constituée d'une partie protéique, la globine, et de l' hème. La globine est formée de quatre chaînes polypeptidiques identiques deux à deux; chaque chaîne est combinée à une molécule d'hème. La structure spatiale de l'hémoglobine, globuleuse, présente des régions hélicoïdales séparées par des sillons. Les hèmes sont dans des poches situées à la surface de la molécule où se fixe l'oxygène. L'hémoglobine chargée d'oxygène, ou oxyhémoglobine, délivre l'oxygène dans les tissus lorsque la pression partielle d'oxygène est faible.⇒HÉMOGLOBINE, subst. fém.Protéine renfermant du fer, contenue dans les globules rouges auxquels elle donne sa couleur, et qui véhicule l'oxygène dans le sang. Seules, les propriétés chimiques de l'hémoglobine, des protéines, et des sels du plasma règlent les échanges, entre les tissus et le sang, de l'oxygène et de l'acide carbonique (CARREL, L'Homme, 1935, p. 234).REM. Hémoglobinurie, subst. fém., pathol. Présence d'hémoglobine dans les urines. L'hémoglobinurie se caractérise par l'émission d'une urine couleur café (GARCIN, Guide vétér., 1944, p. 204).Prononc. et Orth. : [ ]. Att. ds Ac. 1935. Étymol. et Hist. 1872 (LITTRÉ, Add.). Composé de l'élém. hémo- (héma-) et de glob(ule)-ine.hémoglobine [emɔglɔbin] n. f.ÉTYM. 1873; de hémo-, et du rad. de globuline.❖♦ Biol. et cour. Substance protéique contenue dans les globules rouges du sang, et qui renferme du fer. || L'hémoglobine est un pigment respiratoire qui joue un rôle essentiel dans le transport de l'oxygène (⇒ Oxyhémoglobine).❖DÉR. et COMP. Hémoglobinémie, hémoglobinique, hémoglobinopathie, hémoglobinurie. Carbohémoglobine, déshémoglobiniser, méthémoglobine, oxyhémoglobine, sulfhémoglobine.
]. Att. ds Ac. 1935. Étymol. et Hist. 1872 (LITTRÉ, Add.). Composé de l'élém. hémo- (héma-) et de glob(ule)-ine.hémoglobine [emɔglɔbin] n. f.ÉTYM. 1873; de hémo-, et du rad. de globuline.❖♦ Biol. et cour. Substance protéique contenue dans les globules rouges du sang, et qui renferme du fer. || L'hémoglobine est un pigment respiratoire qui joue un rôle essentiel dans le transport de l'oxygène (⇒ Oxyhémoglobine).❖DÉR. et COMP. Hémoglobinémie, hémoglobinique, hémoglobinopathie, hémoglobinurie. Carbohémoglobine, déshémoglobiniser, méthémoglobine, oxyhémoglobine, sulfhémoglobine.
Encyclopédie Universelle. 2012.
